Pasaulē pirmo galvanisko elementu izstrādāja Luigi Galvani. Lasiet par tā vēsturi. šajā rakstāBūtībā tas ir īslaicīgs elektriskās strāvas avots, ko rada ķīmiska reakcija. Elektronu plūsmu rada divu atšķirīgu metālu mijiedarbība. Rezultātā ķīmiskā enerģija tiek pārveidota par elektrisko enerģiju, ko pēc tam var izmantot ikdienas dzīvē.
Koncentrācijas galvaniskā šūna ir strāvas avots, kas sastāv no diviem identiskiem metāla elektrodiem, kas ievietoti šī metāla sāļu maisījumā dažādās koncentrācijās.
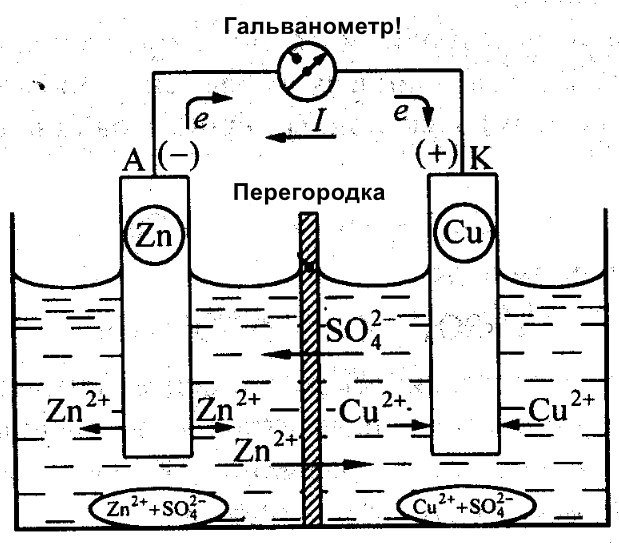
Papildus Galvani, arī Daniels Džeikobi strādāja pie efektīva akumulatora izveides. Viņš nedaudz modificēja savu enerģijas avotu. Tas sastāv no vara plāksnes, kas ievietota CuSO4, un cinka plāksnes, kas iegremdēta ZnSO4. Lai novērstu to tiešu mijiedarbību, starp tām ir ievietota poraina siena. Zemāk ir redzama Daniela Džeikobi galvaniskā elementa diagramma.
Cinkam un varam ir atšķirīga reaģētspēja, un tāpēc to lādiņš atšķirsies. Tā rezultātā arī elektrodu līmeņi nav vienmērīgi. Tas ļauj tiem kustēties un ģenerēt elektrisko jeb galvanisko strāvu. Šī strāva sāk plūst, kad cilvēks vai strāvas uzkrāšanas ierīces izgudrotājs pievieno slodzi. Šī slodze var būt spuldze, radio, datorpele vai citas elektriskās ierīces.
Galvaniskās šūnas shematiska diagramma
Shēmas shēma attiecas uz tās sastāvu un struktūru. To var konstruēt no vairākiem ķīmiskiem elementiem, izmantojot palīgierīces. Zemāk īsumā tiks aprakstīta galvaniskās šūnas struktūra. Lasiet vairāk par to šajā rakstā.!
Galvaniskās šūnas struktūra
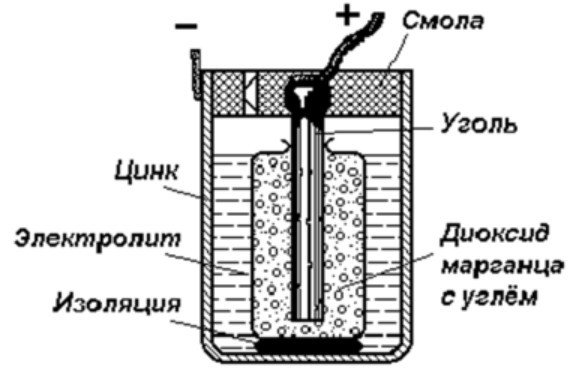
Vienkāršākā enerģijas uzkrāšanas ierīce sastāv no:
- Ogļu stienis.
- Divi atšķirīgi metāli.
- Elektrolīts.
- Sveķi vai plastmasa.
- Izolators.
Kā redzams šajā diagrammā, galvaniskā šūna sastāv no negatīva un pozitīva elektroda. Tās var būt izgatavotas no vara, cinka vai citiem metāliem. Tās sauc par vara-cinka šūnām. Dažreiz tās sauc par sausās baterijas.
Galvaniskās šūnas apzīmējums diagrammā Tas ir veidots divu vertikālu līniju veidā, kas atrodas nelielā attālumā viena no otras. Viena no tām būs mazāka. Katras šādas līnijas malās ir norādes polaritāteGarā līnija ir atzīmēta ar pozitīvu polu, bet īsā līnija - ar negatīvu polu. Spriegums var būt parādīts blakus tai. Tas nozīmē, ka ķēde, kurā tiek izmantota baterija, darbojas tikai ar šo spriegumu.
Galvaniskās šūnas darbības princips
Galvaniskā šūna darbojas, elektroniem pārvietojoties no viena metāla kontakta uz citu. Notiek ķīmiska pārvērtība. Lasiet vairāk par galvaniskās šūnas termodinamiku un galvaniskās elektrības veidošanos. Šeit.
Atbildes uz bieži uzdotajiem jautājumiem
| Galvaniskais | Paskaidrojums |
| Akumulators | Enerģijas avots, kas darbojas, izmantojot procesus, kas notiek slēgtā, miniatūrā telpā. Konkrēti, enerģija tiek ģenerēta ķīmiskas reakcijas rezultātā. |
| Volta šūna vai Volta kaudze | Šis ir enerģijas elements, ko pirmo reizi radīja zinātnieks vārdā Volts. |
| Process | Ķīmisko elementu mijiedarbība, kuras rezultātā rodas elektriskā strāva. |
| Izlāde | Tā ir ķīmiskas reakcijas pabeigšana. Tas nozīmē, ka starp vielām nebūs mijiedarbības. Galvaniskā izlāde ir sastopama Warframe. Būtībā tā ir modifikācija, kuras trūkst. To izmanto tuvcīņas ieročiem. PolaritāteV2. |
| Galvaniskais kontakts | Tas ir kontakts starp elektrodiem un šķīdumu. |
| Efekts | Atšķirības izskats starp diviem kontaktiem, kas izgatavoti no divu veidu metāliem. Lielums ir atkarīgs no vadītāju temperatūras un ķīmiskā sastāva. Būtībā tas ir Voltas pirmais likums. |
| Savienojums/posms/ķēde | Divu vai vairāku elektriskās ķēdes posmu savienošana ar strāvas avotu. |
| Galvaniskais lādiņš | Akumulatora uzpildīšana ar enerģiju. |
Cinkošana ir ķīmisks process, kurā tiek izmantota elektriskā strāva. Reakcija samazina izšķīdušo metāla katjonu daudzumu tiktāl, ka tie galu galā veido vienmērīgu pārklājumu uz metāla elektroda. Rezultātā izstrādājums kļūst izturīgāks, pazūd nelieli iespiedumi un tā izskats kļūst pievilcīgāks.
Galvanisko elementu veidi
Ir vairāki specifiski bateriju veidi.
Galvanisko elementu tabula
| Tips | Spriegums | Galvenās priekšrocības |
| Litijs | 3 V | Liels ietilpība, augsta strāva. |
| Sāls baterijas vai oglekļa-cinka | 1,5 collas | Lētākais. |
| Niķeļa oksihidroksil-NiOOH | 1,6 volti | Augsta strāva. Augsta kapacitāte. |
| Sārmains vai sārmains | 1,6 V | Augsta strāva. Labs skaļums. |
Šī tēma ir sīkāk aplūkota rakstā. bateriju veidi!
Galvaniskās šūnas mērķis
Tas ir paredzēts elektrisko iekārtu iedarbināšanai. Tās var ietvert:
- Skatīties.
- Tālvadības pultis.
- Lukturīši.
- Medicīniskais aprīkojums.
- Klēpjdatori.
- Rotaļlietas.
- Atslēgu piekariņi.
- Telefoni.
- Lāzera rādītāji.
- Kalkulatori.
Un līdzīgas lietas mums apkārt.
Galvaniskā šūna mājās
Vienkāršu barošanas avotu varat izgatavot pats. Lai to izdarītu, jums būs nepieciešami šādi materiāli:
- Plastmasas krūze.
- Elektrolīts. Tas var būt sāls šķīdums, soda vai citronskābe, kas atšķaidīta ūdenī.
- Divu dažādu metālu plāksnes. Piemēram, alumīnijs un varš.
- Vadi
Ražošanas process
Paņemiet plastmasas krūzi un ielejiet tajā elektrolītu. Nepiepildiet to līdz malām; vislabāk atstāt 1-2 centimetrus īsu atstarpi. Piestipriniet vadus pie metāla plāksnēm. Pēc tam novietojiet vara un alumīnija plāksnes uz trauka malām. Tām jābūt paralēlām viena otrai. Kad viss ir gatavs, varat izmērīt spriegumu ar voltmetru.
Pievienojiet ierīci un pieskarieties zondēm pie mūsu barošanas avota kontaktiem. Turiet tās vietā, līdz displejā parādās spriegums. Parasti tas ir 0,5–0,7 volti. Šīs vērtības ir atkarīgas no elektrolīta vai, precīzāk, no vielas, kas tiek izmantota kā elektrolīts.
Lūk, kā tiek izgatavota mājās gatavota galvaniskā šūna.